Medicamentul, cunoscut sub numele de molnupiravir, a redus riscul de spitalizare sau deces cu 50% într-o analiză intermediară a unui studiu clinic în stadiu avansat, au declarat vineri într-o declarație Merck și partenerul Ridgeback Biotherapeutics LP.
Rezultatele studiului au fost atât de încurajatoare încât Merck și Ridgeback, companie cu participație restrânsă, în urma consultării cu monitorii independenți ai studiului și cu Administrația americană pentru alimente și medicamente, au ales să oprească înscrierea pacienților și să înceapă procesul de obținere a autorizației de reglementare.
"Nu am putea fi mai încântați de rezultate", a declarat directorul executiv al Merck, Rob Davis, într-un interviu. "Nu trebuie să mergi la spital, nu trebuie să mergi la un centru pentru a fi perfuzat. Este o pastilă pe care o poți lua acasă".
Companiile plănuiesc acum să solicite o autorizație de utilizare de urgență de la FDA cât mai repede posibil, a spus Davis.
Anthony Fauci, șeful Institutului Național de Alergii și Boli Infecțioase, a calificat datele ca fiind impresionante și a indicat că autoritățile de reglementare se vor mișca rapid pentru a le analiza odată ce cererea va fi depusă.
"Întotdeauna ezităm să stabilim termene", a declarat Fauci în cadrul unei ședințe de informare a Grupului de lucru pentru coronavirus de la Casa Albă de vineri, adăugând că FDA, "în modul lor obișnuit, foarte eficient și eficace, va examina datele cât mai repede posibil".
Dacă medicamentul va ajunge pe piață, acesta ar marca o etapă importantă în pandemie. Deși există mai multe medicamente disponibile pentru tratarea Covid-19, acestea pot fi fie greoaie de administrat pacienților, fie destinate utilizării doar în cazul celor mai grav bolnavi.
Până în prezent, nu a existat nicio opțiune ușor de utilizat pentru persoanele infectate, dar care nu sunt încă suficient de bolnave pentru a avea nevoie de îngrijiri spitalicești. Acest lucru i-a lăsat pe mulți îngrijitori în fața unei alegeri dificile: trimiterea acasă a persoanelor infectate pentru a încerca să reziste bolii și a risca să se agraveze, sau internarea mai multor pacienți în unitățile de terapie intensivă care sunt adesea deja aglomerate.
Citește și: Un nou medicament care va salva vieți, aproape de a ajunge pe piață
Alte tratamente
Terapiile cu anticorpi monoclonali realizate de companii precum Eli Lilly & Co., Regeneron Pharmaceuticals Inc. și GlaxoSmithKline Plc și partenerul Vir Biotechnology Inc. au fost autorizate de FDA pentru a trata forme de Covid-19 ușoare până la moderate. În timp ce medicamentele au fost din ce în ce mai solicitate în multe state, acestea necesită o perfuzie, ceea ce poate spori presiunea asupra sistemelor de sănătate.
Alte medicamente sunt folosite pentru a trata pacienți mult mai bolnavi. Remdesivirul de la Gilead Sciences Inc. a fost unul dintre primele terapii care a obținut o autorizație din partea FDA, dar este destinat celor spitalizați. Iar steroidul ieftin dexametazonă, deși foarte eficient, este de obicei folosit doar în cazul celor mai grav bolnavi.
Oficialii din domeniul sănătății din SUA au subliniat în mod constant că vaccinurile sunt principalul instrument de combatere a pandemiei și, până în prezent, peste 75% dintre americanii eligibili au primit cel puțin o doză.
Cu toate acestea, mai rămân încă milioane de persoane vulnerabile la infecție, iar valul recent de îmbolnăviri stimulat de răspândirea variantei delta a pus o povară semnificativă asupra spitalelor din zonele cu rate de imunizare mai scăzute.
Citește și: Tratament anti COVID-19. Tehnici și medicamente actuale
Molnupiravirul ar oferi medicilor o opțiune pentru a ține pacienții infectați departe de camerele de urgență. Acesta este destinat utilizării la pacienții Covid-19 neinternați care au avut simptome timp de cinci zile sau mai puțin și care prezintă riscul unei infecții grave. Acesta face parte dintr-o clasă de medicamente numite analogi nucleozidici care vizează mecanismul de reproducere al virusului.
Analiza planificată
Constatările Merck și Ridgeback au reieșit dintr-o analiză planificată anterior a 775 de pacienți care au participat la studiul clinic de la începutul lunii august.
Până la 29 de zile, niciunul dintre participanții care au luat molnupiravir nu a murit, comparativ cu opt decese în grupul placebo.
Merck intenționează să prezinte datele și altor autorități de reglementare din întreaga lume. Aceasta a precizat în declarație că se așteaptă să producă 10 milioane de cure de tratament până la sfârșitul anului, iar în 2022 se așteaptă și mai mult.
În iunie, compania a convenit cu guvernul american asupra unui contract de furnizare de 1,2 miliarde de dolari, în baza căruia va furniza 1,7 milioane de cure de tratament.
La începutul acestei săptămâni, Merck a prezentat alte date din cercetările în fază incipientă care arată că molnupiravirul pare să inhibe mai multe variante majore ale coronavirusului, inclusiv tulpina delta, foarte contagioasă.
Acțiunile Atea Pharmaceuticals Inc, o companie de biotehnologie care își dezvoltă propriul medicament antiviral împreună cu Roche Holding AG, a urcat cu până la 33% după anunțul Merck și Ridgeback.
Fiți la curent cu ultimele noutăți. Urmăriți DCBusiness și pe Google News
Ţi s-a părut interesant acest articol?
Urmărește pagina de Facebook DCBusiness pentru a fi la curent cu cele mai importante ştiri despre evoluţia economiei, modificările fiscale, deciziile privind salariile şi pensiile, precum şi alte analize şi informaţii atât de pe plan intern cât şi extern.
 EUR = 4.9775
EUR = 4.9775  USD = 4.3576
USD = 4.3576  GBP = 5.8057
GBP = 5.8057  CHF = 5.2994
CHF = 5.2994  XAU = 465.6930
XAU = 465.6930 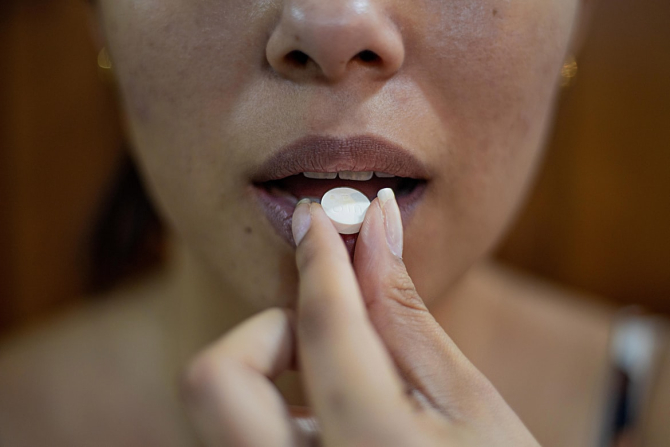













































 1 AUD = 2.7950 RON
1 AUD = 2.7950 RON  1 DKK = 0.6667 RON
1 DKK = 0.6667 RON  1 CAD = 3.1558 RON
1 CAD = 3.1558 RON  1 HUF = 0.0122 RON
1 HUF = 0.0122 RON  1 JPY = 0.0307 RON
1 JPY = 0.0307 RON  1 NOK = 0.4195 RON
1 NOK = 0.4195 RON  1 SEK = 0.4555 RON
1 SEK = 0.4555 RON  1 BTC = 403253.04RON
1 BTC = 403253.04RON  1 ETH = 7719.01RON
1 ETH = 7719.01RON  1 LTC = 359.37RON
1 LTC = 359.37RON  1 XRP = 9.44RON
1 XRP = 9.44RON 





